В предыдущих частях мы рассматривали клетку как «черный ящик», сравнивая её с компьютером: ДНК – как двоичный код программы, органоиды – как модули процессора, а всю клетку – как сложный виртуальный город с изолированными процессами. Однако для полного реверс-инжиниринга биологических систем одного лишь наблюдения извне недостаточно. Хотелось бы заглянуть внутрь клетки прямо во время работы, подобно тому как инженеры просматривают внутренние сигналы микрочипа с помощью логических анализаторов. В этой статье мы обсудим концепцию искусственной клетки-посредника (аналог Man-in-the-Middle в ИТ), которая могла бы вживляться рядом с живой клеткой (или внутрь неё) и перехватывать информацию о её работе в реальном времени, не нарушая естественных процессов.
Идея состоит в создании крошечного биоробота – искусственной клетки, способной обмениваться сигналами с живой клеткой. Такая «клетка-перехватчик» должна быть биосовместимой и выполнять двойную роль: незаметно считывать внутренние процессы клетки (химические сигналы, механические движения органелл, электрические потенциалы и т.д.) и при необходимости воздействовать на клетку (например, посылать сигнал или вводить реагент) для экспериментов. Подобный подход перевёл бы анализ клетки на новый уровень, позволяя «заглянуть» в виртуальный город изнутри и даже вмешиваться в его работу контролируемым образом.
В дальнейшем мы структурируем эту концепцию, рассмотрим возможные технические варианты реализации и сравним с уже существующими прототипами технологий для изучения клетки in vivo. Также оценим, насколько такие инструменты реальны сегодня, сколько времени и ресурсов может потребоваться для их создания, и какие перспективы открывает их появление для биологии и медицины.
Концепция искусственной клетки-посредника
Искусственная клетка-посредник (био-наноробот) – это гипотетический микроскопический прибор, имитирующий размеры и некоторые свойства живой клетки, способный внедряться в ткань (например, с помощью тонкой иглы) и устанавливать тесный контакт с целевой клеткой. Назовём её «клетка-шпион». Она должна действовать как «man-in-the-middle»-устройство: перехватывать сигналы, проходящие между клеткой и окружающей средой, и передавать информацию наружу исследователю. В идеале такая искусственная клетка также могла бы инициировать сигналы, воздействуя на реальную клетку или её соседей, чтобы наблюдать реакцию – своего рода активный debugging биосистемы.
Как можно управлять и общаться с такой клеткой-посредником? Рассмотрим несколько вариантов связи и контроля:
Беспроводная связь (радиоканал или индукция): Самый заманчивый вариант – полностью автономный наноробот, который получает энергию извне (например, через радиочастотное или ультразвуковое излучение) и передает данные по беспроводному каналу. Однако реализовать радиопередатчик и приемник на масштабе десятков микрон крайне сложно с точки зрения энергетики и размеров антенны. Тем не менее, первые шаги в этом направлении уже делаются. Например, существуют проекты «нейронной пыли» и микророботов с пассивными датчиками: крохотные устройства (размером порядка 50–100 мкм), которые могут получать питание от внешнего поля и передавать сигналы изменением резонансных характеристик цепи[1][2]. В недавней работе (2023) описан прототип беспроводного микроробота с катушкой-индуктором (~50–500 мкм) на борту, способный реагировать на изменения среды и передавать данные по принципу пассивного RLC-датчика[3][4]. Тем не менее, такие устройства пока больше подходят для измерений в относительно крупных масштабах (сотни микрон) и далеки от настоящего размера клетки. Радиоканал в наномире – маловероятен на текущем этапе, хотя миниатюрные антенны и пьезоэлементы (для ультразвуковой связи) активно исследуются.
Оптоволоконный проводник (оптический кабель): Более реалистичный подход – тончайшее оптоволокно, напрямую связанное с искусственной клеткой. Волокно играет роль «пуповины», по которой передаются команды и выходит информация. Через этот оптоканал можно подводить свет для подсветки внутриклеточных структур и получать оптические сигналы высокой четкости. В идеале на конце такого волокна должна быть крошечная камера или датчик. Поскольку в глубине живой клетки темно и фотонов мало, придётся подсвечивать внутренние структуры – например, синим лазером для возбуждения флуоресцентных меток. Именно так поступили исследователи из Беркли, создав наноскопический эндоскоп: они прикрепили нанопроволоку из диоксида олова (SnO₂) к кончику оптоволокна, получив гибкий нанозонд для визуализации внутри клетки[5][6]. Свет, идущий по волокну, эффективно переходил в нанопроволоку и излучался с её острия, подобно фонарику, освещая органеллы в непосредственной близости[7]. Этот нанозонд можно вводить внутрь клетки, и он не вызывал гибели или повреждения – столь мал его диаметр[8]. Более того, через такой зонд удалось передавать «груз» внутрь клетки: на кончик нанопроволоки с помощью светочувствительной связи привязали квантовые точки и затем, уже находясь внутри клетки, отсоединили их ультрафиолетовым импульсом[9]. Таким образом, оптоволоконная связь позволяет не только заглянуть в клетку, но и точечно воздействовать на неё.
Химико-механический интерфейс (поверхностный контакт): Ещё один вариант – искусственная клетка, плотно прилегающая к мембране исследуемой клетки и снимающая информацию о происходящем внутри косвенно, через биохимические маркеры. Представим, что мембраны реальной и искусственной клетки соприкасаются, или между ними образован нанометровый «мостик» (например, в виде соединительного канала или нановорсинки). Тогда изменения концентрации ионов, молекул сигналов или активность мембранных белков целевой клетки могут ощущаться датчиками на искусственной клетке. Пример: нанодатчики на основе нанопипеток способны измерять концентрации отдельных молекул, pH или ионов кальция, если их кончик помещён вблизи интересующей области[10]. В научной литературе описаны всевозможные миниатюрные сенсоры: нанотрубки на кончике АСМ-зонда, оптические нанофибры, наноспирали, наноэлектроды и даже наночастицы, которые могут служить своеобразными «щупами» внутри клетки[11]. Например, группа в Дрексельском университете ещё в 2010 году продемонстрировала наноэндоскоп из углеродной нанотрубки, прикреплённой к стеклянной микропипетке[12]. Такой зонд цилиндрической формы проникает глубоко в клетку, причиняя ей минимальный урон, и может одновременно проводить оптическую и электрохимическую диагностику на уровне отдельных органелл[13]. Это стало новым этапом в исследовании клеток: теперь возможно одновременно наблюдать сразу несколько процессов внутри живой клетки, не убивая её и не смешивая всё содержание, как это происходило бы при традиционном лизисе[14][15]. То есть одна искусственная «клетка-посредник» способна выступать множеством сенсоров сразу.
Таким образом, наиболее осуществимым видится решение с тонким оптоволоконным или нанопроводным соединением, обеспечивающим и питание, и передачу сигналов, либо в комбинации с локальными химическими/механическими сенсорами на поверхности искусственной клетки. Внутри такого био-наноробота могут размещаться чувствительные элементы: фотодетекторы (как сетчатка глаза, но в микромасштабе), наномикрофоны для улавливания акустических колебаний, нано-FET транзисторы для измерения электрических потенциалов и т.д. (подробнее о них – ниже). Интересно, что сама природа частично подсказывает решения: например, настоящие клетки имеют митохондрии – «энергостанции», производящие электрохимическую энергию. Возможно, искусственную клетку можно снабдить аналогом митохондрий – скажем, миниатюрными батареями или механизмами получения энергии из окружающей среды (глюкоза, кислород), чтобы снизить зависимость от внешнего провода.
Также клетка-робот могла бы иметь поверхность, покрытую рецепторами, похожими на клеточные, чтобы достоверно имитировать соседнюю клетку. Тогда живая клетка «примет» её как свою и будет посылать сигналы в ответ на привычные стимулы. А наша искусственная клетка будет эти сигналы ловить и передавать учёным. В свою очередь, получив команду, она может выбросить определённый молекулярный сигнал, активируя соседние клетки или вызывая ответную реакцию – получается двухсторонняя связь.
Важно понимать, что такая сложная система пока во многом гипотетическая. Чтобы оценить её реалистичность, рассмотрим существующие сегодня технологии, которые приближают нас к «прозрачному» для исследований живому клеточному миру.
Обзор существующих прототипов и технологий
Несмотря на то, что полноценной искусственной клетки-шпиона ещё нет, наука уже демонстрирует ряд впечатляющих инструментов для внутриклеточного зондирования. Эти разработки можно считать «строительными блоками» для будущего комплексного устройства. Расскажем о них подробнее:
1. Наноэндоскопы на оптоволокне
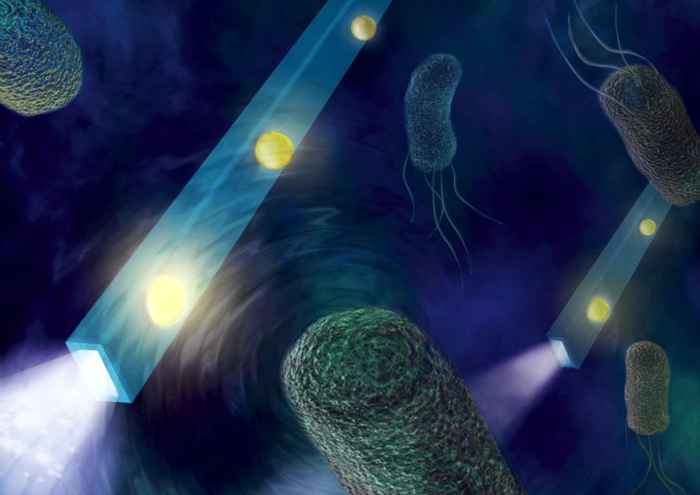
Рис. 1: Схематическое изображение нанозонда на основе оптического волокна с наночастицами (золотые точки). Такой зонд способен внедряться в клетку (здесь показана бактерия) и фиксировать мельчайшие механические колебания внутри, преобразуя их в изменения интенсивности света, проходящего по волокну. Источник: Naked Science (иллюстрация в рамках описания Nature Photonics 2017).
Оптические микроскопы давным-давно позволяют наблюдать живые клетки без разрушения, но их разрешение ограничено дифракционным барьером – примерно 200–300 нм в лучшем случае. А ведь в клетке полно структур меньшего размера! Современные методы суперразрешения (STED, PALM, STORM) или электронная микроскопия дают нанометровую точность, но либо требуют убить клетку (фиксация, вакуум, срезы), либо чрезвычайно сложны и не подходят для динамического наблюдения внутри живой клетки[16][17]. Наноэндоскопы решают эту проблему радикально: они проникают прямо внутрь клетки и работают там как крошечные глаза и фонарики.
Как это устроено? Классический пример – уже упомянутый нанопровод SnO₂ на оптоволокне от команды Пэйдона Янга (Беркли)[18]. Диаметр нанопроволоки меньше длины волны света, поэтому она обходится без дифракционных ограничений. Свет лазера по оптоволокну поступает в нанопровод и излучается с его кончика внутри клетки, освещая близлежащие молекулы. От них исходит флуоресцентный сигнал, который тот же нанопровод собирает и возвращает по волокну к детектору[19]. В 2011 г. таким методом в живых клетках HeLa визуализировали кластеры квантовых точек внутри цитоплазмы, добившись субклеточного разрешения, недоступного обычной оптике[20]. Позже эта же группа и другие исследователи улучшили конструкцию: например, оптимизировали профиль конца зонда для локализованной съёмки с точностью ~100 нм[21][22]. Более того, нанопроволочный эндоскоп оказался достаточно прочным и гибким – он выдерживает многократные изгибы, проколы мембран, не ломаясь[23].
Помимо визуализации, наноэндоскоп может служить инъектором и локальным стимулятором. Мы уже приводили пример с доставкой квантовых точек: за счёт светочувствительных линкеров груз «отстёгивается» в нужном месте клетки по команде[9]. Потенциально, аналогично можно доставлять гены, лекарственные молекулы, сенсоры. Также, подавая через зонд излучение определённой длины волны, можно активировать фотохимические процессы локально. Представьте – точечное выключение или включение гена светом внутри одной клетки, пока соседние не затронуты.
Другой пример оптического нанозонда – волоконно-механический датчик. Группа Дональда Сэрбули (UC San Diego) в 2017 г. разработала сверхтонкое оптоволокно (сотни раз тоньше волоса), покрытое слоем гибкого полимера с вкраплёнными золотыми наночастицами[24][25]. Когда такой нановолоконный детектор погружён в живую клетку или рядом с ней, даже крошечные механические колебания – скажем, биение бактериального жгутика – вызывают сжатие полимера, и наночастицы вдавливаются глубже. В результате меняется интенсивность света, проходящего через оловянную нить внутри волокна, и это фиксируется приборами[25]. Чувствительность оказалась феноменальной: прибор улавливает силы менее 160 фемтоНьютонов и звук ниже –30 дБ[26], то есть фактически слышит шёпот молекул. Такая «суперслышимость» открывает путь к прямому измерению движений отдельных молекулярных моторов внутри клетки – например, работы дининов, перемещающих груз по микротрубочкам, или открытие и закрытие ионных каналов (ведь это тоже механическое действие).
Важно отметить, что оптоволоконные зонды уже достаточно миниатюрны, чтобы проникать в клетки млекопитающих, и биосовместимы, если их покрыть подходящими материалами (тем же фосфолипидом или гидрогелем). Они не требуют сложной электроники на кончике – вся обработка сигнала происходит вне клетки, что упрощает дизайн. Коммерчески подобные зонды пока не доступны, но многие лаборатории уже используют стеклянные нанопипетки и оптические нитевидные сенсоры в опытных установках. Следующий шаг – сделать такие устройства массовым инструментом, вроде стеклянных микропипеток в свое время.
2. Наноэлектроды и нано-FET: цифровой «прослушивающий жучок» внутри клетки
Параллельно с оптическими методами развивается направление наноэлектронных биозондов. Идея здесь – ввести внутрь клетки крошечный электронный компонент (например, транзистор), который непосредственно измеряет электрические или биохимические параметры и передает их наружу в цифре. Пионер этого подхода – Чарльз Либер (Гарвардский университет). Его команда создала нанометровый транзистор на основе кремниевой нанопроволоки, столь малый, что он сравним по размеру с вирусом[27]. Этот транзистор расположен около изгиба U-образной нанопроволоки, а «плечики» U служат проводниками (исток и сток). Весь зонд трёхмерный и выступает из плоскости чипа, как миниатюрная рогатка[28][29], благодаря чему его можно внедрить в клетку, преодолев «тиранию подложки», которая мешала плоским наноустройствам контактировать с объёмными объектами вроде клеток[30].
Самое изящное решение Либера – покрытие нанозонда слоем фосфолипидов. Когда они попытались вводить голый нанопроволочный FET в клетку, та разрывалась и погибала[31]. Но стоит одеть зонд в липидную оболочку (аналогичную мембране клетки), как он сам втягивается внутрь через мембрану путём эндоцитоза[32]! Клетка «обманывается», принимая его за нечто биологическое – наподобие вирусной частицы – и позволяет проникнуть без повреждений. Этот прорыв показал, что на наноразмерах граница между живым и искусственным стирается, и правильно сконструированный наноробот может вести себя как естественный объект для клетки[33][34].
Что же умеет этот нано-FET? Будучи активным транзисторным зондом, он не просто регистрирует сигнал, но и усиливает его прямо на месте[35]. Первые эксперименты показали, что такие наноприборы могут измерять электрические потенциалы внутри нейронов (например, потенциалы действия) и внутри кардиомиоцитов (импульсы, заставляющие клетку сердца биться)[36]. Причём, благодаря малому размеру, зонд может одновременно фиксировать несколько сигналов в разных участках одной клетки – скажем, потенциал около мембраны и потенциал внутри митохондрии[37]. Это похоже на многоканальный осциллограф, подключенный к отдельным узлам электронного устройства, только узлы тут – органеллы. Кроме того, никто не мешает функционализировать поверхность нанопровода: присоединить к нему рецептор, который распознает конкретный химический молекулярный сигнал (гормон, метаболит) и преобразует его связывание в изменение электрического сигнала транзистора[38]. Либер прямо указывает, что nanoFET можно оснастить лигандом для измерения экспрессии определённых РНК или белков[39] – то есть превратить в биосенсор концентрации веществ.
По сути, нано-FET-зонды – это первая прямая стыковка цифровой электроники с живой клеткой, что было немыслимо ещё пару десятилетий назад[40]. «Наш прорыв впервые даёт возможность напрямую интерфейсировать цифровую электронику с живыми клетками таким образом, что грань между этими двумя информационно-вычислительными системами жизни фактически размывается» – сказал Либер, комментируя свою работу[40]. Этот подход признан революционным: он назван «первым полностью новым подходом к изучению внутриклеточных процессов за несколько десятилетий»[40]. В перспективе, сеть из множества нанотранзисторов могла бы облепить или пронизать клетку, снимая комплексную картину электрической активности и химических реакций в реальном времени. А учитывая, что транзистор – элемент двухсторонний (через него можно не только читать, но и подавать сигналы), возникают фантастические сценарии: запись внешнего управляющего сигнала внутрь клетки. Например, посыл короткого импульса, чтобы стимулировать определённый канал или запустить каскад внутри клетки – своего рода «внутриклеточная электрическая стимуляция». В интервью Либер даже упоминал, что такие устройства могут лечь в основу гибридных «био-цифровых компьютеров» или точечной нейростимуляции в мозге[41].
Конечно, реализация нанотранзисторов внутри реальных тканей – задача непростая. Устройства Либера пока испытывались на отдельных клетках в культурах. Есть сложности с массовым производством идентичных нанозондов, их позиционированием, защитой от биологической деградации. Тем не менее, параллельно развиваются и более простые наноэлектроды – например, остро заточенные нановолокна серебра или углерода, способные измерять уровень нейромедиаторов через окислительно-восстановительные реакции или записывать электрическую активность с высоким сигнал-шумом[11]. Интересное направление – «наношприцы» с электродами для электрофизиологии: в кончик стеклянной нанопипетки внедряют углеродную нанотрубку, которая действует как электрод внутри клетки, при этом сама пипетка может вводить вещество. Такие гибридные инструменты позволяют одновременно стимулировать и записывать отклик клетки. Всё это – элементы того самого «набора шпиона», который требуется нашей искусственной клетке-посреднику.
3. Молекулярные нанопипетки и зонды для химического анализа
Помимо оптики и электроники, не забываем и про химию – язык, на котором говорит сама клетка. Очень ценные данные можно получить, если научиться точечно отбирать пробы из разных областей клетки и анализировать состав. Традиционная биохимия так и делает – дробит клетку и измеряет концентрацию веществ, но при этом вся пространственная привязка теряется (это как узнать среднюю температуру по больнице). Нам же нужно знать, что происходит, к примеру, в ядре по сравнению с цитоплазмой, или внутри синаптического пузырька по сравнению с межклеточной средой.
Для этого учёные придумали нанопипетки – стеклянные микропипетки, вытянутые до нанометрового диаметра. Такие крохотные шприцы способны проколоть мембрану и всосать буквально пиколитры жидкости из определённого места клетки. Далее можно либо проанализировать отобранное вещество (например, на масс-спектрометре), либо сразу в кончике пипетки стоит датчик. Существуют нанопипеточные сенсоры на разные молекулы: их внутреннюю поверхность покрывают молекулами, связывающими искомый анализат, и при связывании меняется, к примеру, ионный ток через пипетку. Так измеряли pH внутри отдельных органелл, концентрацию ионов кальция, молекул АТФ и прочее[10]. Другой метод – поверхностно-усиленная спектроскопия комбинационного рассеяния (SERS): если на кончике зонда есть наночастица золота или серебра, она может служить усилителем рамановского сигнала, позволяя регистрировать спектр молекул прямо внутри клетки[42]. Этот спектр – как «химический отпечаток пальца» среды, по нему можно одновременно видеть присутствие множества веществ.
Ещё один инструмент – атомно-силовая микроскопия (АСМ) в режиме nano-endoscopy. В 2020-х годах появилось расширение АСМ: зонд микроскопа (острейшая игла) вводится не снаружи по поверхности клетки, а внутрь клетки через мембрану. Затем им сканируют изнутри, ощупывая структуры цитоскелета, органелл и т.д. Недавно с помощью такого приёма удалось даже получить 3D-карту расположения актиновых филаментов внутри живой клетки[43]. Это фактически механическое ощупывание структуры клетки изнутри, без внедрения посторонних маркеров. Комбинируя АСМ-зонд с флуоресцентной микроскопией, можно сопоставлять механическую карту и химические метки, строя весьма полную картину. Правда, АСМ-эндоскопия – довольно инвазивный метод и технически сложный (требуется гасить вибрации, контролировать нажатие в реальном времени, чтобы не угробить клетку), но потенциал огромен. Можно представить, что молекулярный щуп искусственной клетки – это мини-версия АСМ: крошечный выдвижной «манипулятор», который, проникнув в область, способен прощупать окружение и выявить, какие молекулы где расположены.
Напоследок отметим быстро развивающуюся область синтетических клеток и полусинтетических биосенсоров. Здесь подход немного иной: вместо того чтобы внедрять прибор в клетку, создают искусственные липидные мешочки (аналог клеточных везикул или простейших клеток), начиняют их сенсорными системами (например, ферментами или ДНК-аптамерами, которые меняют флуоресценцию при связывании вещества), и помещают рядом с живыми клетками. Такие мини-лаборатории могут химически общаться с настоящими клетками. В экспериментах были продемонстрированы двусторонние коммуникации между искусственной и живой клеткой: например, искусственная клетка реагирует на сигнальную молекулу, выделяемую бактериями, и в ответ выбрасывает другую молекулу, которую бактерии воспринимают[44]. Это похоже на диалог, только через химические слова. Есть проекты по созданию искусственных нейронов, которые могут принимать электросигналы и выдавать нейромедиаторы, связываясь с настоящими нейронами[45]. Пока такие системы далеки от интеграции с электроникой (сигнал приходится считывать оптически или химическим анализом), но будущее биосенсоров, вероятно, объединит лучшие черты биологии и техники.