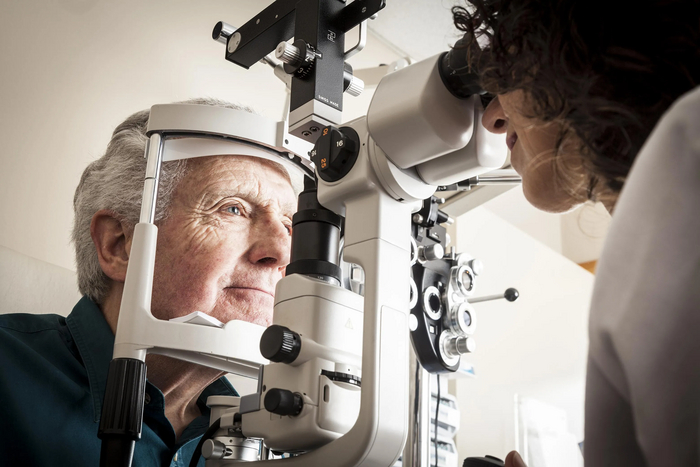
К нам обратилась 17-летняя девушка с распространенным эпидермальным невусом (ЭН) (фото 1 А-B).
В остальном она была здорова, если не считать склонности к болям в спине. Ее родители вспоминали, что впервые у нее появился ЭН, когда ей было 4 месяца. Первоначально ЭН проявлялся в виде гиперпигментированных линейных полос, которые постепенно увеличивались в размере и толщине, становясь более приподнятыми и бородавчатыми. Коричневая, покрытая папилломами и бархатистая кожа ЭН повторяла линии Блашко, с полосами и завитками на теле, резко обрывающимися на срединой брюшной линии. ЭН распространялся на шею, волосистую часть головы и конечности и присутствовал на лице (фото 2).
У нее было также поражение слизистой нижней губы (рис. 3)
и слизистой оболочки щек вблизи углов рта. У нее не было никаких дисморфологических признаков и ее лицо, туловище и конечности казались симметричными с нормальными пропорциями, хотя рентгенологическое исследование позвоночника выявило минимальный грудной сколиоз. Осмотр глаз был ничем не примечательным, а неврологическое обследование было нормальным.
После информированного согласия пациентки и ее родителей была взята пункционная биопсия с кожи поверхности грудной клетки толщиной 4 мм. При гистологическом исследовании биопсия показала слегка папилломатозную поверхность с неспецифическим слоистым гиперкератозом и акантозом, типичными для ЭН.
У пациентки был диагностирован двусторонний системный кератиноцитарный невус неэпидермолитического подтипа. Мацерация в интертригинозных областях вызывала беспокойство, но повторные лазерные процедуры (оксид углерода и Nd:YAG) не принесли большого успеха, поскольку повреждения кожи либо рецидивировали, либо образовывали рубцы.
Биопсия кожи была взята из ЭН на брюшной полости и прилегающей нормальной кожи после информированного согласия пациента в соответствии с рекомендациями местного комитета по этике и Хельсинкской декларацией. Из этих биоптатов были выделены отдельные культуры фибробластов. ДНК была выделена непосредственно из биоптатов кожи, а также из культивированных фибробластов. Кроме того, для анализа были доступны зафиксированный в формалине биоптат, лейкоциты крови, соскобы с пораженной слизистой оболочки щек, корни волос на голове и уротелиальные клетки из осадка мочи . ДНК была выделена из этих тканей и клеток с использованием стандартных протоколов. Мутации FGFR3 и PIK3CA были проанализированы с помощью анализов SNaPshot®, как описано
ранее. Мы идентифицировали мутацию точки FGFR3 R248C в ткани ЭН, но не в прилегающей нормальной коже. Мутация R248C была также обнаружена в тканях слизистой оболочки щеки, собранных с помощью щечных щеток. Напротив, мутация R248C не была обнаружена ни в культивируемых фибробластах пораженной, ни в нормальной кожи, ни в корнях волос на пораженной коже волосистой части головы, ни в уротелиальных клетках. Ни в одном из образцов ткани не было обнаружено мутаций в гене PIK3CA.
Иммуногистохимическое окрашивание ткани ЭН антителом FGFR3 (Santa Cruz Biotechnology, Санта-Круз, США) выявило экспрессию белка FGFR3 во всем эпидермальном слое, но интенсивность окрашивания была сопоставима с контролем на нормальной коже.
Результаты показывают, что синдром системного кератиноцитарного невуса у данной пациентки вызван мозаичностью мутации R248C FGFR3. Этот мозаицизм распространился на слизистую оболочку полости рта и вызвал внутриротовые поражения. Генетический мозаицизм может быть ограничен эпидермисом, но может также распространяться на другие ткани, приводя к возникновению синдромов ЭН. Доля пациентов с ЭН с дополнительными аномалиями других систем органов неизвестна и может варьироваться в зависимости от различных подтипов ЭН.
У пациентки, описанной в этом отчете, мутация R248C FGFR3 была идентифицирована в тканях кожи и слизистой оболочки щек (эктодерма), а также в значительной доле лейкоцитов крови (мезодерма).
Учитывая участие двух эмбриологических тканей, можно сделать вывод, что мутация произошла на очень ранней стадии, в клетке, потомки которой включали клетки кожи и гематогенные клетки-предшественники. Раннее появление мутации может быть причиной широкого распространения кожных заболеваний.
Насколько нам известно, мы впервые смогли показать, что мозаичная мутация FGFR3 может быть связана с внутриротовыми поражениями, что в других случаях является необычным наблюдением. Последовательность данного типа в неповрежденной коже, корнях волос и культивируемых фибробластах нашего пациента подтверждает, что мутация R248C произошла в мозаичной форме, ограниченной эпителием и отсутствующей в стромальном компоненте кожи. Мы предполагаем, что этот случай представляет собой синдром ЭН, учитывая наличие мутации в лейкоцитах крови, указывающей на поражение костного мозга. Даже незначительный сколиоз может быть частью синдрома, хотя это может быть случайным совпадением и не зависеть от мозаичности. До настоящего времени мутация R248C FGFR3 была выявлена в двух случаях синдрома ЭН: - у одного пациента с дисморфизмом лица, а у другого пациента с поражением головного мозга. Было предложено предварительное обозначение “синдром FGFR3 ЭН”, в то же время признавая, что генетическая гетерогенность может лежать в основе клинического фенотипа этого синдрома Пациентам с обширным ЭН показано обследование на предмет наличия синдрома ЭН даже при отсутствии явных внекожных признаков, как в нашем случае.
Кроме того, важно знать, что эти пациенты могут иметь предрасположенность к злокачественным новообразованиям внутренних органов, особенно к уротелиальным опухолям низкой степени злокачественности. До сих пор не было сообщений о выявлении мутаций FGFR3 у пациента с ЭН, ассоциированных с уротелиальным раком или другими злокачественными новообразованиями. Однако мутации FGFR3 вовлечены в патогенез опухолей мочевого пузыря, карциномы шейки матки и множественной миомы. Риск для данного пациента трудно оценить, хотя отсутствие мутации FGFR3 в уротелиальных клетках позволяет предположить, что, по крайней мере, при раке мочевого пузыря он может быть низким. Риск злокачественной трансформации опухоли (например, базально-клеточной карциномы или плоскоклеточного рака), по-видимому, также невелик, хотя сообщалось о единичных случаях.
Если мозаицизм FGFR3 поражает гонады, у нашей пациентки есть риск рождения потомства с танатофорной дисплазией. Существует прецедент, связанный с этим у пациентки с обширным мозаицизмом мутации R248C FGFR3, включая широко распространенный черный акантоз кожи и дисплазию скелета.
Мы показываем, что мозаичность мутации R248C FGFR3 может вызывать системный ЭН с поражением слизистой оболочки полости рта. Пациентам с обширным ЭН необходимо обследование для обнаружения “ЭН-синдрома”, поскольку внекожные проявления ЭН-синдрома могут быть малозаметными. Поскольку мозаицизм половых желез при мутации R248C FGFR3 не может быть полностью исключен, существует риск рождения потомства с танатофорической дисплазией. Таким образом, пренатальная диагностика мутации R248C будет проводиться при будущих беременностях нашей пациентки.
Переведено и опубликовано: Кожный