По какой-то неведомой мне причине, при изучении номенклатуры неорганических соединений, преподавателями выдаётся список анионов солей и кислот, который предлагается запомнить. При этом никаких объяснений почему то или иное вещество называется именно так, не предоставляется. А уж когда речь заходит о комплексных соединениях, начинается полная печаль. В связи с этим, хотелось бы пролить свет на данный вопрос и объяснить правила (ну или хотя бы основы правил) формирования названий для большинства неорганических соединений.
Заранее стоит оговориться, что для полного понимания смысла данного материала, необходимо знать, что такое степень окисления и как она определяется.
Для любителей смотреть и слушать предлагаю видеоформат:
Для любителей текстовых вариантов — текстовый формат.
Итак. Названия химических соединений — это в любом случае слова и правила русского языка для них не чужды. А значит любое название имеет корень и может иметь приставки и суффиксы. Начнём с корней.
Здесь представлены некоторые корни, которые будет давать "названиеобразующий" элемент:
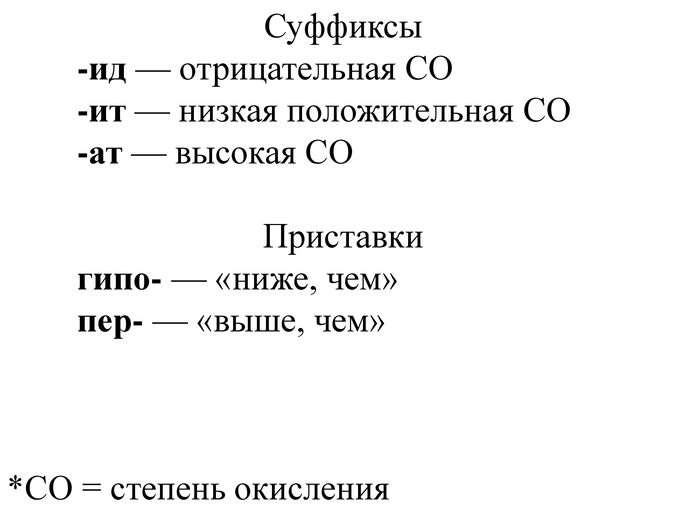
Помимо корней необходимо знать также приставки и суффиксы:
Теперь о принципах наименования соединений. Если соединение бинарно (т.е. состоит из двух элементов), то название будет давать атом, имеющий отрицательную степень окисления. Так как их степень окисления отрицательна, то и суффикс будет соответствующий — "-ид".
Если же соединение содержит более двух атомов, а в состав входит ещё и кислород, то название будет давать элемент, атом которого находится перед кислородом. И в зависимости от его степени окисления суффикс будет либо "-ит" либо "-ат". Или на примерах:
Обратите внимание, что в соединении K2SO3 стоит суффикс "-ит", а в соединении K2CO3 — суффикс "-ат". Это связано с тем, что сера находится в 6 группе, а значит её максимальная степень окисления +6, из чего следует, что +4 для серы — низкая степень окисления. Углерод же находится в 4 группе и степень окисления +4 для него максимально высокая степень окисления.
В случае же, когда атом одного элемента имеет более трёх устойчивых степеней окисления, для соединений, в котором элемент, дающий название, имеет положительную степень окисления, в ход идут приставки. Суффиксы "-ит" и "-ат" применяются для промежуточных степеней окисления, а для самой высокой и самой низкой положительной степеней окисления применяют приставки так, чтобы по смыслу получалось "ниже, чем низкая" и "выше, чем высокая". Примеры приведены ниже:
Возможно, некоторые из читателей заметили, что углерод и кремний имеют два корня. Это связано с особенностями русского языка. Так, в соединениях, где углерод проявляет степень окисления -4 применяется корень "карб-", однако, в соединениях, где углерод проявляет степень окисления +4 применяется корень "карбон-". Аналогичная ситуация с кремнием. Кремний -4 даёт корень "силиц-", тогда как кремний +4 даёт корень "силик-".
Также стоит сказать пару слов об особенности употребления приставки "пер-". Эта приставка употребляется, как правило, в двух случаях. Первый — это для обозначения элемента в степени окисления +7, а второй — когда нужно указать, что атом имеет не минимально возможную, отрицательную степень окисления. Так, например, кислород, который имеет минимальную степень окисления -2, может образовывать соединения, в которых его степень окисления будет равна -1. Так как -1 — это выше, чем -2, то мы вправе использовать приставку "пер-" и в таком случае у нас будет получаться пероксид.
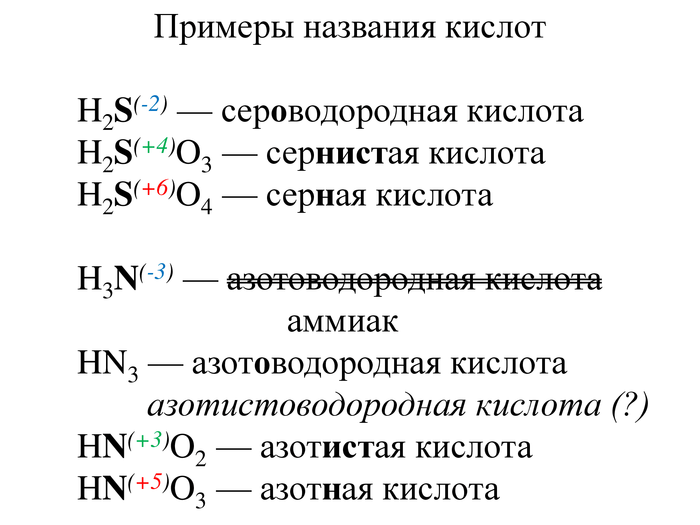
Теперь поговорим о названиях кислот. С ними немного интереснее. Для бескислородных кислот используется русский корень элемента и через соединительное "о" присоединяется "-водородная кислота". Для кислородной кислоты с атомами элемента в низких степенях окисления также используется русский корень и суффиксы "-ист-" или "-нист-", в высоких степенях окисления — суффикс "-н-"
Исторически сложилось, что водородное соединение азота называют аммиак (равно как фосфорное — фосфин, кремниевое — силан, углеродное — метан и т.д. Это характерная особенность для элементов IV и V групп). В связи с этим название азотоводородная кислота (по другим источникам азотистоводородная кислота) применяется к соединению HN3, также именуемое азидоводородом.
Для соединений, где образующие название атомы имеют более двух положительных степеней окисления, используются следующие суффиксы:
Также стоит знать названия части сложных катионов и анионов, которые невозможно назвать по приведённым выше правилам:
А так же названия числовых приставок:
При помощи числовых приставок, в частности, обозначают, какое количество атомов элемента, образующего название, приходится на одну структурную единицу вещества:
Отдельно стоит остановиться на названиях кислых и основных солей. Водород в солях обозначают приставкой "гидро-", гидроксильную группу обозначают приставкой "гидроксо-", не забывая про приставку "ди-", если таких групп две:
Зачастую катионы в соединении могут иметь разные степени окисления, поэтому, если для катиона такое возможно, в названии этого соединения после названия катиона в скобочках указывается его степень окисления римскими цифрами:
С другой стороны, может применяться номенклатура, по которой числовыми приставками указывается количество катиона и количество аниона (если приставки нет, значит такая структурная единица одна):
В двойных или смешаных солях названия катионов или анионов перечисляются через дефис:
Если соединение является кристаллогидратом (то есть в своей кристаллической решётке помимо самого вещества содержится ещё и вода), то названия для таких веществ формируется следующим образом:
Следует помнить, что эти названия будут применяться только для твёрдых кристаллических веществ. У вас не может быть раствора пентагидрата сульфата меди (II) (или другими словами раствора медного купороса), а может быть только раствор сульфата меди (II), так как при растворении вода из кристалла смешается с водой, в которой мы растворяем вещество и, по сути, не будет разницы между растворённым кристаллогидратом и безводной солью.
Названия комплексных соединений у многих вызывает дикий ужас, хотя правила номенклатуры для них достаточно простые:
Здесь также необходимо запомнить как обозначаются в комплексных соединениях некоторые молекулярные лиганды (их на самом деле больше, но мы не будем вдаваться в экзотику):
И применяя правила можно легко назвать нейтральные, катионные:
В названиях комплексных кислот, как и в названиях обычных, необходимо применять русские корни:
Обладая этими знаниями и умея их применять, можно с лёгкостью давать названия (или по названию определять формулу) для большинства неорганических соединений.
Разумеется, для использования приведённой мной методики нужно выучить некоторое количество слов, однако, в отличие от повсеместно предлагаемого тупого заучивания названий анионов и кислот, этот метод позволяет не только существенно уменьшить количество заучиваемого материала, но и даёт возможность понимать о чём идёт речь впервые услышав название какого-то соединения.